2018信州総文祭
教科書通りの実験の盲点!?想定と異なる結果を徹底検証! 〜硝酸銀水溶液とアンモニア水の反応〜
【化学】福島県立安積黎明高校 化学部
(2018年8月取材)

■部員数 20人(うち1年生6人・2年生4人・3年生10人)
■答えてくれた人 佐久間詩歩さん(3年)
硫酸銀水溶液とアンモニア水の反応に関する研究
教科書の解説と実験結果の違いに着目!
高校の化学の教科書には、反応として次のようなものが解説されています。

「硝酸銀水溶液に少量のアンモニア水を加えると、酸化銀の褐色沈殿が得られる」。

しかし、実際にこの実験を行ってみると、白色沈殿が生じることがありました。
そこで私たちは、白色沈殿が生じる原因を探り、その正体を突き止めることを目的に研究を行いました。
実験1:白色沈殿は水酸化銀なのか?
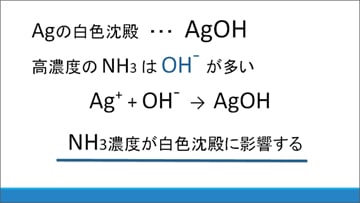
まず、銀の白色沈殿としてよく知られているものに水酸化銀があります。
もし生じた白色沈殿が水酸化銀であれば、NH3水(アンモニア水)の濃度を変えればそれに応じてOH-(水酸化物イオン)濃度も変化し、白色沈殿の生成量に影響を与えるのではないかと考え、実験を行いました。
NH3水の濃度変化が白色沈殿に与える影響を調べるため、次の材料を用意しました。
(1)0.01 mol/L, 0.1 mol/L, 1~6 mol/Lまで、1 mol/L刻みで変化させた8段階のNH3水
(2)0.1 mol/LのAgNO3(硝酸銀)水溶液3 mL
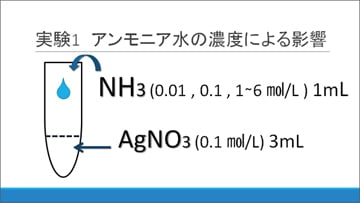
(1)をそれぞれ(2)に加えていった結果、低濃度では褐色の沈殿が生じた一方、高濃度ではこの褐色沈殿が瞬間的に生じたのち、すぐに溶解して消失しました。
これはどちらも一般的に知られているNH3水とAgNO3水溶液の反応の結果であり、高濃度の条件下で褐色沈殿が消失したのは、ジアンミン銀イオン(Ⅰ)が生じたからだと考えられます。このことから、NH3水の濃度は白色沈殿の生成に影響を与えていないことがわかりました。
実験2:溶液の長期保存が白色沈殿に影響?
次に私たちは、白色沈殿の生成は、どちらかの溶液の長期保存によるものではないかという仮説を立てました。
そこで、次の実験では溶液の保存状態による影響を調べることにしました。用意したのは次の材料です。
(1)3種類の濃度で4か月間保存したNH3水
(2)上記と同じ濃度で、新しく調製したNH3水
(3)1年間保存したAgNO3水溶液
(4)上記と同じ濃度で新しく調製したAgNO3水溶液
これらを組み合わせて反応させ、観察しました。
結果、(1)の長期間保存したNH3水であればいずれの濃度においても、白色沈殿が生成しており、(3)(4)のAgNO3水溶液の保存期間による影響は見られませんでした。
したがって、白色沈殿の生成にはNH3水の長期保存が影響していたことがわかります。このことから、時間経過に伴い、NH3水に何らかの化学変化が起こったと考えられます。

実験3:NH3水の保存状態による影響は?
そこで私たちはこの現象についてさらに詳しく調べるために、NH3水の保存状態を変えて実験を行いました。用意したのは、次のものです。
(1)パラフィルム(密閉)で覆ったNH3水
(2)市販のラップで覆ったNH3水
これについて、毎日pHと白色沈殿が生じるかどうかを調べました。
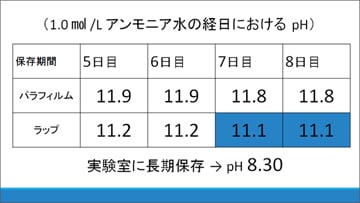
結果、(1)のパラフィルムで覆った場合は8日目に至るまで大きなpHの変化もなく、白色沈殿も生じませんでしたが、(2)の市販ラップで覆った場合は7日目でpHが11.1になり、白色沈殿が生じました。また、実験室で長期保存したNH3水のpHは8.30でした。
密閉度の低いラップで覆った際に液性が変化したことから、大気中の何らかの成分が影響しているのではないかと私たちは考えました。
影響しているのは、大気中の二酸化炭素?
NH3水の液性を変化させた成分は、大気中の二酸化炭素であると仮説を立てました。長期間大気に触れて保存されているNH3水の中では、一部のアンモニアが炭酸アンモニウムに変化します。これがAgNO3水溶液に加えた際に反応し、炭酸銀の沈殿を生じると考えました。

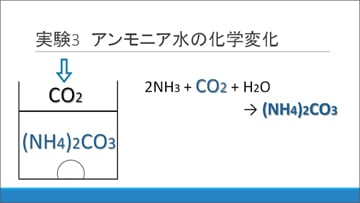
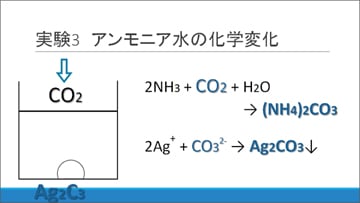
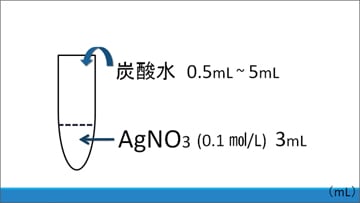
そこでこの仮説について検証するため、炭酸水による化学変化に関する実験を行いました。用意したのは次の材料です。
(1)AgNO3水溶液
(2)0.5~5 mLまで0.5 mLずつ変化させた10段階の量の炭酸水
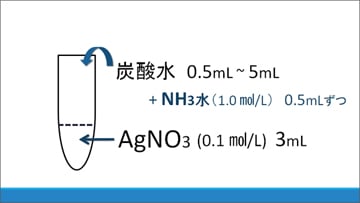
(3)NH3水 (※実験の途中からあらためて用意した)
(1)に(2)を直接加えたところ、予想に反し、いずれの場合も白色沈殿は生じませんでした。

このことから、NH3水が反応に影響を与えていると考え、さらに(3)のNH3水も加えて変化を観察しました。すると、すべての場合において白色沈殿が観察できたため、NH3水のpHが白色沈殿生成の要因であると推測しました。

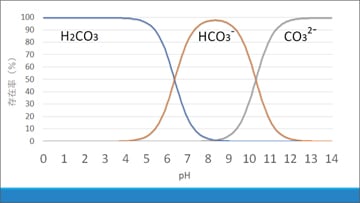
pHと、水溶液中の炭酸、炭酸水素イオン、炭酸イオンの存在率の関係を示すグラフを確認します。すると、pHが8より大きいときに炭酸イオンが存在していることがわかります。
これを踏まえ、AgNO3水溶液に炭酸水を加えた際はpHが酸性側に偏ってしまうため炭酸イオンが生じませんが、NH3水を加えることでpHが大きくなり、炭酸イオンの存在率が大きくなり、炭酸銀の白色沈殿を生成しやすくなったのではないかと考察しました。実験室で長期保存したNH3水のpHは8.30であったことからも、炭酸イオンが存在していたと考えることができます。
実験4:白色沈殿物の正体は炭酸銀?
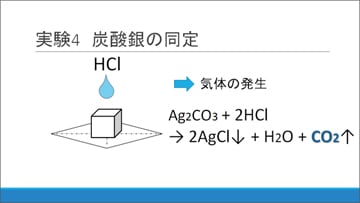
白色沈殿物が炭酸銀であるかを確認するため、白色沈殿に塩酸を滴下した様子を観察しました。その結果、気体の発生が見られました。
これが二酸化炭素であったとすると、弱酸の遊離が起こったと考えられ、白色沈殿の正体は炭酸銀であったということができそうです。
実験5:液性の条件と沈殿の関係は?
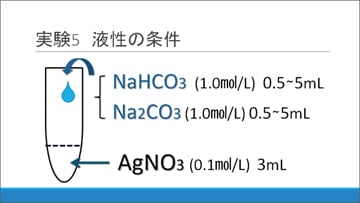
液性の条件と沈殿の様子の関係を調べます。
(1)加水分解すると塩基性を示す塩であるNa2CO3(炭酸ナトリウム)
(2)NaHCO3(炭酸水素ナトリウム)1.0 mol/L水溶液
これらを、それぞれ0.5から5.0 mLまで0.5 mLずつ増やしながらAgNO3水溶液に加えていき、沈殿の生成を観察しました。
NaHCO3を加えた場合、若干淡黄色に近い白色沈殿が生じました。

Na2CO3を加えた場合も白色沈殿が生じましたが、若干黒っぽく、NaHCO3を加えた場合に比べ、量はやや少ない傾向にありました。

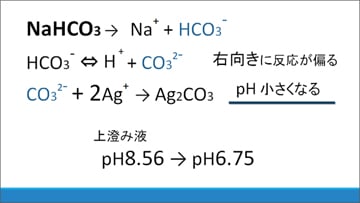
まず、NaHCO3水溶液を加えた場合について考察します。
炭酸銀が生成するとCO32-が減るために、HCO3-(炭酸水素塩)が電離してH+とCO32-が生じる可逆反応の平衡が右に移動します。その結果、pHが小さくなると推測できます。
実際に沈殿が生じた後の上澄み液のpHを調べると、8.56から6.75へ減少していたことから、炭酸銀の生成反応が進行していたと考えられます。

次に、Na2CO3を加えた場合に沈殿が黒っぽく濁ったことについて考察します。
これは、炭酸銀以外にAg2O(酸化銀)が生成したことが原因だと考えました。
溶解度積を比較すると、酸化銀の方が炭酸銀よりも小さいため、沈殿が生じやすいことがわかります。またpHが大きくなるとO2-の濃度が上昇するので、酸化銀が増加すると考えられ、塩基性条件下では酸化銀生成と炭酸銀生成が競合するといえます。
白色沈殿の正体がわかった!
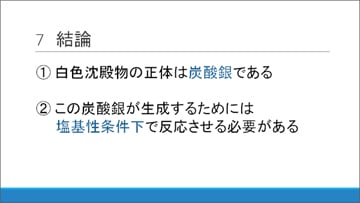
以上の結果から、NH3水にAgNO3水溶液を混ぜた際に生じる白色沈殿の正体は炭酸銀であり、この生成には水溶液が塩基性であるという条件が必要であることがわかりました。
この白色沈殿が生じるpH域は8.0~11程度と考えられますが、今後の課題として、より厳密にpH域を決定していきたいと考えています。
■研究を始めた理由・経緯は?
この反応を生徒実験で行った際、本来であれば褐色沈殿が生じなければならないところ、白色沈殿が生成したことに疑問を持ち、研究を始めました。
■今回の研究にかかった時間はどのくらい?
1週間あたり平均4.5時間で、約7か月です。
■今回の研究で苦労したことは?
実験の過程で、pHがコロコロと変化してしまうことです。
■「ココは工夫した!」「ココを見てほしい」という点は?
・溶液中の反応や実験操作など、この研究の全般にわたって高校の化学の知識や実験設備で十分説明できること。
・炭酸銀という白色沈殿が生じる原因に、一見関係がなさそうなアンモニア水がpH調整に大きく関わっていること
■今回の研究にあたって、参考にした本や先行研究
・高校化学の教科書や図説
・「スクエア最新図説化学」第一学習社
・「化学便覧基礎編改訂5版」日本化学会編(丸善株式会社)
■今回の研究は今後も続けていきますか?
一定の成果が得られたので続けることはないと思います。
■ふだんの活動では何をしていますか?
・サイエンスボランティア(地域の科学館でのサイエンスショーの実施)
・研修旅行(研究機関、科学館、大学の見学など)
・科学の甲子園
などです。
■総文祭に参加して
初めて全国大会に参加でき、大変光栄に思いました。2日間にわたって、高いレベルの研究をたくさん知ることができましたし、いずれの研究も考察に至るまで詳細にまとめてあり、ただただ感心するばかりでした。宿舎でも、発表の練習をするだけではなく、夜遅くまで学習に取り組んでいる姿を見て、一受験生としても刺激を受けました。他の専門部の発表を見学することができなかったのが残念でしたが、信州総文祭に参加できたことは非常に良い経験でした。
 みらいぶっくグループ
みらいぶっくグループ






